
82 |
Jahresbericht 2014
Ärztekammer
Nordrhein
Medizinische Grundsatzfragen
Wirkstoff, jedoch in einer anderen Studie als der
von der EK bewerteten Studie aufgetreten ist. Da-
mit entfiel einer der häufigsten Gründe für das
Zurücksenden von Berichten, und in der Folge hat
sich die Relation zwischen zurückgesandten und
aufgenommenen Berichten umgekehrt.
Unerwünschte Ereignisse, sogenannte „Vor-
kommnisse“, die in einer gemäß dem
MPG
durchge-
führten klinischen Prüfung auftreten, werden aus-
schließlich an das Bundesinstitut für Arzneimittel
und Medizinprodukte berichtet.
Schwerwiegende unerwünschte Ereignisse oder
Verdachtsfälle unerwarteter schwerwiegender
Nebenwirkungen in 2013
Gemäß
§ 42 Abs. 3 Satz 2 Nr. 1 AMG
müssen Ne-
benwirkungen und sonstige unerwünschte Ereig-
nisse, die während einer Studie auftreten und die
Sicherheit der Studienteilnehmer oder die Durch-
führung der Studie beeinträchtigen könnten, an die
zuständige EK berichtet werden (SUEs). Zusätzlich
regelt seit August 2004 die
GCP-Verordnung
für da-
nach begonnene Studien nach dem
AMG
die Mel-
depflicht von Verdachtsfällen unerwarteter schwer-
wiegender Nebenwirkungen (SUSARs).
Die Geschäftsstelle der EK bewertet diese Berich-
te. In zusammenfassenden Listen werden die aufge-
nommenen Berichte über SUEs/SUSARs der EK
vorgelegt. Seit dem Inkrafttreten des
2. AMGuaÄndG
im Oktober 2012 gelten Änderungen der Melde-
pflichten des Sponsors: Seither sind SUSAR-Berich-
te auch dann an die EKen zu senden, wenn ein Ver-
dachtsfall zwar im Zusammenhang mit demselben
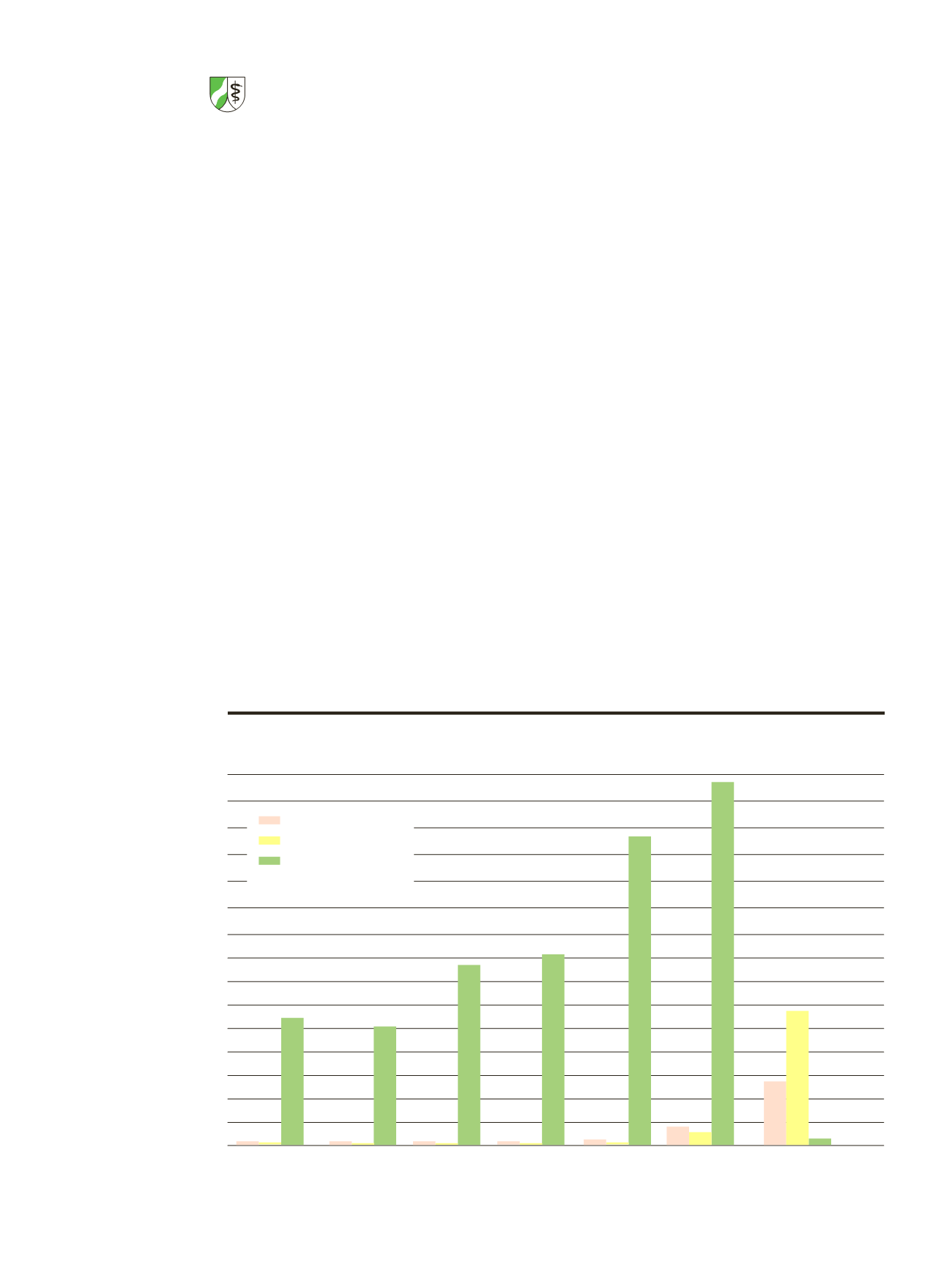
7.500
7.000
6.500
6.000
5.500
5.000
4.500
4.000
3.500
3.000
2.500
2.000
1.500
1.000
500
2007
2008
2009
2010
2011
2012
2013
2.526
3.809
4.088
6.354
7.320
3
38
2.825
349
1
1.474
25
1
40
66
139
453
43
67
84
aufgenommene Berichte
Nachbewertungen u.a.
zurückgeschickt
2.720
Anzahl der Berichte über schwerwiegende unerwünschte Ereignisse
2007 – 2013 (vor allem SUSARs)
Informationen, Checklisten und
Formblätter zur Antragstellung
finden sich im Internet unter
www.aekno.de/Ethikkommission .


















