
84 |
Jahresbericht 2016
Ärztekammer
Nordrhein
Medizinische Grundsatzfragen
Schwerwiegende unerwünschte Ereignisse oder
Verdachtsfälle unerwarteter schwerwiegender
Nebenwirkungen
Gemäß
§ 42 Abs. 3 Satz 2 Nr. 1 AMG
müssen Neben-
wirkungen und sonstige unerwünschte Ereignisse,
die während einer Studie auftreten und die Sicher-
heit der Studienteilnehmer oder die Durchführung
der Studie beeinträchtigen könnten, an die zustän-
dige EK berichtet werden (SUEs). Zusätzlich regelt
seit August 2004 die
GCP-Verordnung
für danach be-
gonnene Studien nach dem
AMG
die Meldepflicht
von Verdachtsfällen unerwarteter schwerwiegen-
der Nebenwirkungen (SUSARs). In zusammenfas-
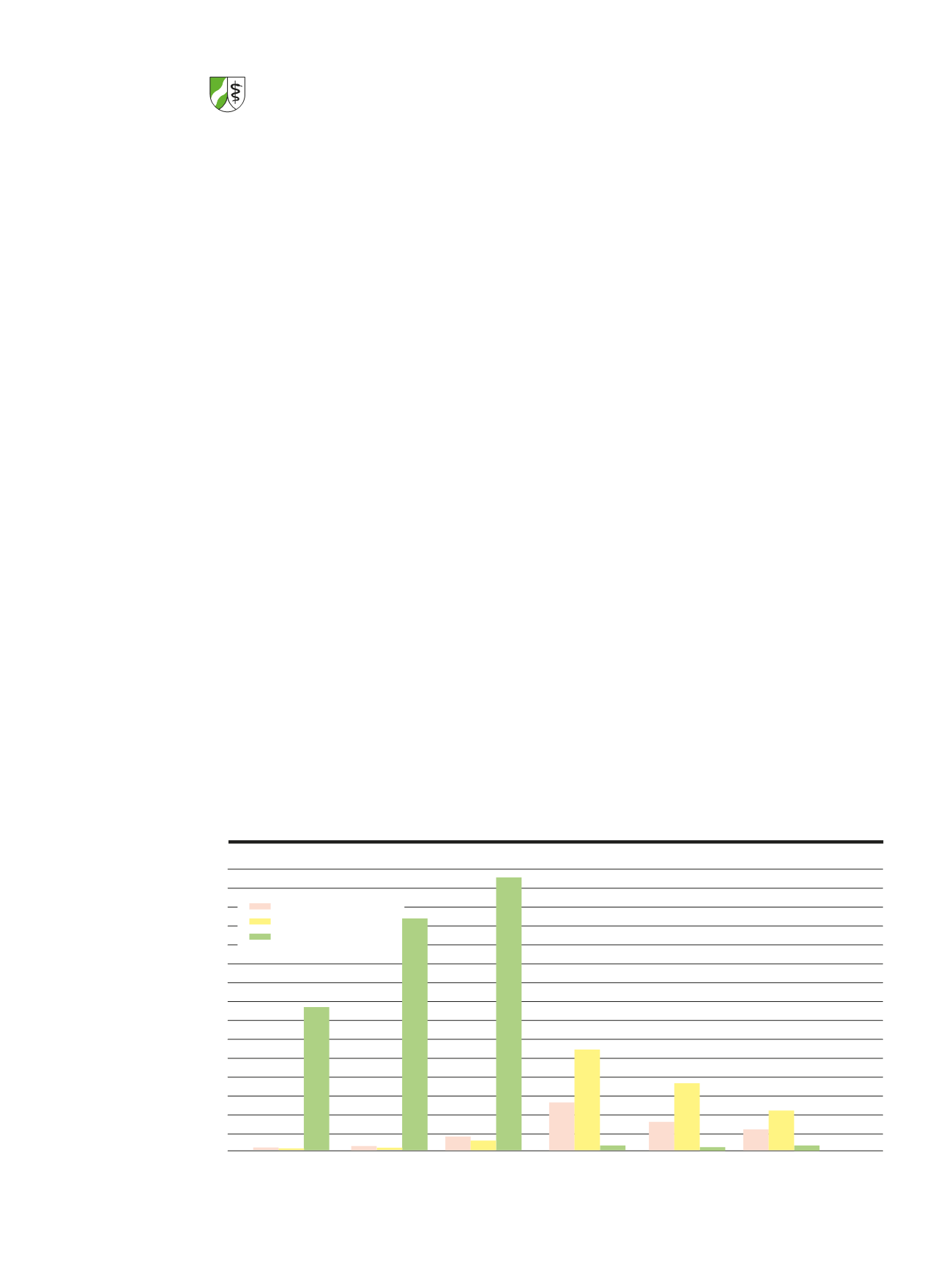
senden Listen legt die Geschäftsstelle der EK die
aufgenommenen Berichte über SUEs/SUSARs vor
(siehe
T
abelle 4)
. Seit Oktober 2012 sind SUSAR-Be-
richte auch dann an die EKen zu senden, wenn ein
Verdachtsfall im Zusammenhang mit demselben
Wirkstoff, dabei jedoch in einer anderen Studie als
der von der EK bewerteten Studie, aufgetreten ist.
Dies erklärt die seitherige Zunahme aufgenomme-
ner Berichte und Nachbewertungen im Verhältnis
zu den vor diesem Zeitpunkt zurückgeschickten, da
irrelevanten Berichten. Unerwünschte Ereignisse,
sogenannte „Vorkommnisse“, die in einer gemäß
dem MPG durchgeführten klinischen Prüfung auf-
treten, werden ausschließlich an das Bundesinstitut
für Arzneimittel und Medizinprodukte berichtet.
Gründe für das Zurücksenden von Berichten
• Fehlende Stellungnahme des Sponsors,
dass die Sicherheit der Studienteilnehmer oder
die Durchführung der Studie beeinträchtigt sein
könnte.
• SUE bzw. SUSAR hatte nach Aussage des Sponsors
oder Leiters der klinischen Prüfung keine Relevanz
für die von der EK beratene Studie.
• SUSAR war nicht in der von der EK beratenen Studie
aufgetreten, und es fehlte eine Diskussion der
Relevanz für die Studie (bis 25.10.2012).
• Die Ethikkommission war als beteiligte EK
nicht zuständig.
• Die Definition eines SUSARs wurde nicht beachtet.
Doppelmeldung/ungenügende Angaben/
unzureichende Lesbarkeit
SUE:
Schwerwiegendes unerwünschtes Ereignis
SUSAR:
Verdachtsfall einer unerwarteten schwerwiegenden
Nebenwirkung
7.500
7.000
6.500
6.000
5.500
5.000
4.500
4.000
3.500
3.000
2.500
2.000
1.500
1.000
500
2010
2011
2012
2013
2014
2015
4.088
7.320
38
2.825
1.946
1.171
1
1.474
851
666
25
17
54
139
453
43
aufgenommene Berichte
Nachbewertungen u.a.
zurückgeschickt
Anzahl der Berichte über schwerwiegende
unerwünschte Ereignisse 2010-2015 (vor allem SUSARs)
Informationen, Checklisten und Formblätter
zur Antragstellung
finden sich im Internet unter
www.aekno.de/Ethikkommission .349
6.354
















