76 |
Jahresbericht 2013
Ärztekammer
Nordrhein
Medizinische Grundsatzfragen
vorgesehenen Zeitplan wird das Inkrafttreten der
Verordnungen in 2015 erwartet. Die Umsetzung
wird danach unter Beachtung der geplanten Über-
gangsregelungen erfolgen.
Statistik und Zahlen
Im Jahr 2012 hat die Ethikkommission in 52 Sit-
zungen sowie im schriftlichen Umlaufverfahren
insgesamt 1.065 Anträge – davon 484 Neuanträge
und 581 bewertungspflichtige nachträgliche Ände-
rungen – begutachtet und bewertet.
Schwerwiegende unerwünschte Ereignisse oder
Verdachtsfälle unerwarteter schwerwiegender
Nebenwirkungen 2012
Gemäß
§ 42 Abs. 3 Satz 2 Nr. 1 AMG
müssen Ne-
benwirkungen und sonstige unerwünschte Ereig-
nisse, die während einer Studie auftreten und die
Sicherheit der Studienteilnehmer oder die Durch-
führung der Studie beeinträchtigen könnten, an die
zuständige EK berichtet werden (SUEs). Zusätzlich
regelt seit dem August 2004 die
GCP-Verordnung
für danach begonnene Studien nach dem
AMG
die
Meldepflicht von Verdachtsfällen unerwarteter
schwerwiegender Nebenwirkungen (SUSARs). Die
Geschäftsstelle der EK bewertet diese Berichte nach
ihren unten genannten Kriterien. In zusammenfas-
senden Listen werden die aufgenommenen Berichte
über SUEs/SUSARs der EK vorgelegt
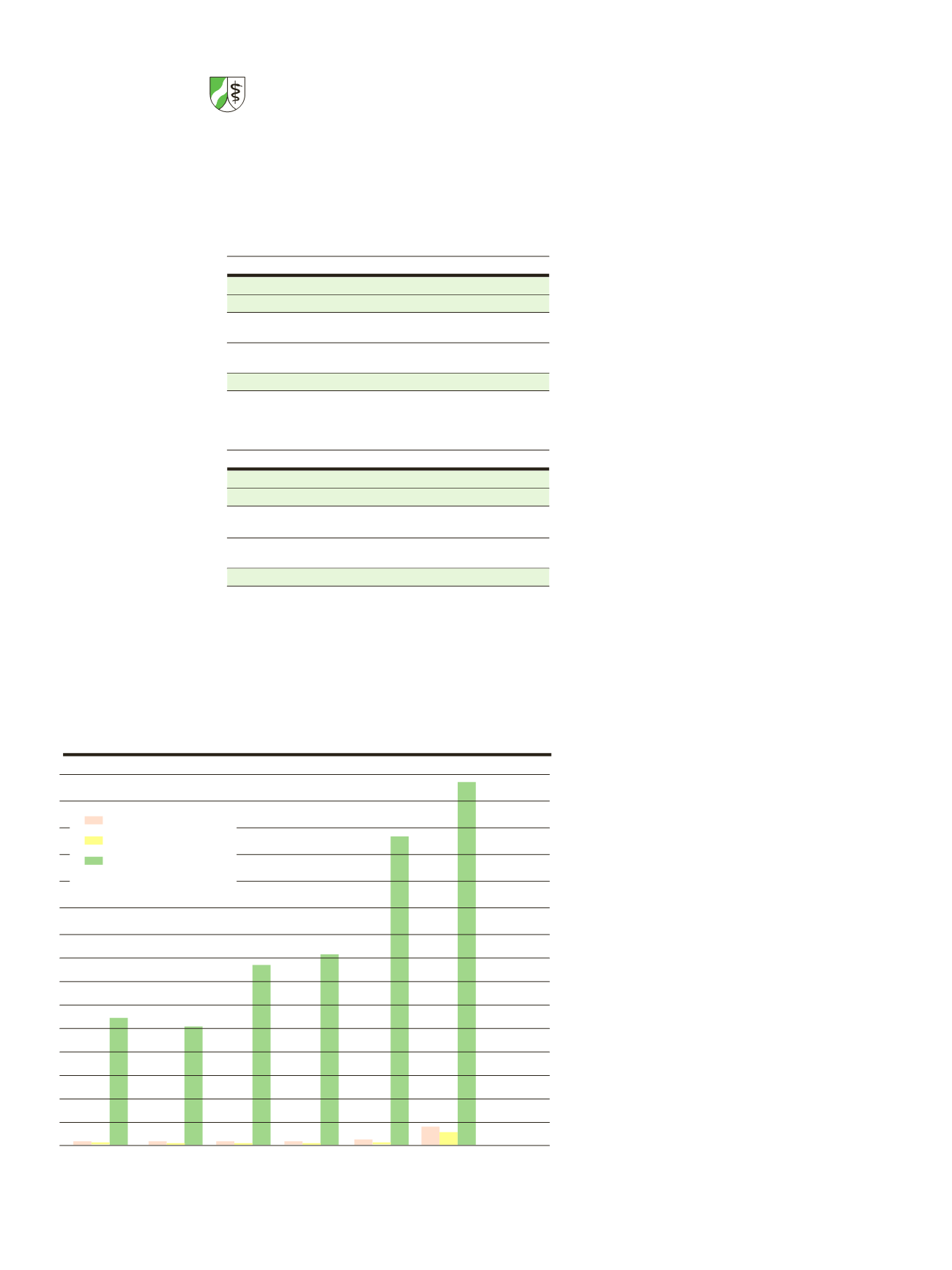
(siehe Grafik)
.
Seit dem Inkrafttreten des
2. AMGuaÄndG
im Okto-
ber 2012 gelten Änderungen der Meldepflichten des
Sponsors: Seither sind SUSAR-Berichte auch dann
an die EKen zu senden, wenn ein Verdachtsfall
zwar im Zusammenhang mit demselben Wirkstoff,
jedoch in einer anderen Studie als der von der EK
bewerteten Studie aufgetreten ist. Unerwünschte
Ereignisse, sogenannte Vorkommnisse, die in einer
gemäß dem
MPG
durchgeführten klinischen Prü-
fung auftreten, werden ausschließlich an das Bun-
desinstitut für Arzneimittel und Medizinprodukte
berichtet.
Nach einem Kriterienkatalog auf Basis des
AMG
und der
GCP-V
werden zugesandte Berichte, die für
die jeweils beratene Studie irrelevant sind, in der
Geschäftsstelle gesichtet und konsequent an den
Absender zurückgesandt.
Tabelle 1: Gliederung der Neuanträge 2012
AMG
MPG
§ 15 BO*
Monozentrisch
54
4
32
Multizentrisch
241
20
138**
a. davon als federführende
Kommission
17
3
b. davon als mitberatende
Kommission
224
17
Gesamt
295
24
170
Tabelle 2: Bewertungspflichtige Nachträgliche Änderungen 2012
AMG
MPG
§ 15 BO*
Monozentrisch
47
10
9
Multizentrisch
432
17
66**
a. davon als federführende
Kommission
154
11
b. davon als mitberatende
Kommission
278
6
Gesamt
479 27
75
* darin enthalten auch Studien nach § 15 BO i.V.m. § 23b MPG
und nicht-interventionelle Studien
**Eine Unterscheidung zwischen federführender Ethikkommission
und mitberatender Ethikkommission gibt es im berufsrechtlichen
Verfahren nicht.
SUE:
Schwerwiegendes
unerwünschtes Ereignis
SUSAR:
Verdachtsfall einer
unerwarteten schwer-
wiegenden Nebenwirkung
7.500
7.000
6.500
6.000
5.500
5.000
4.500
4.000
3.500
3.000
2.500
2.000
1.500
1.000
500
2007
2008
2009
2010
2011
2012
2.526
3.809
4.088
6.354
7.320
3
38
349
1
1
40
66
139
453
43
67
84
aufgenommene Berichte
Nachbewertungen u.a.
zurückgeschickt
2.720
Anzahl der Berichte über schwerwiegende unerwünschte Ereignisse
2007 – 2012 (vor allem SUSARs)
Informationen, Checklisten und Formblätter
finden sich im Internet
unter


